临床实践中,生物类似药的治疗效果能否与原研生物药媲美呢?生物类似药是否会与原研生物药分庭抗礼,进而取而代之呢?针对这些疑问,本文带您一探究竟。
在肿瘤治疗领域,生物药凭借高效低毒的优势已然成为了抗肿瘤治疗的主流药物,在肿瘤治疗发挥着不可或缺的作用。近年,随着原研生物药专利到期及生物技术的不断发展,以原研生物药为基础的生物类似药蓬勃发展,全球呈现出如火如荼、风生水起的研发局面。截至2019年5月29日,Clarivate Analytics Cortellis数据库共收录生物类似药972个,其中单克隆抗体占52.4%。
我国也不例外,目前已成为生物类似药在研数量最多的国家,有270个生物类似药处于研发中,同时有4个单抗类生物类似药于2019年相继获批上市。
那么,在此种境况下,不由让人心生疑问:生物类似药的治疗效果能否与原研生物药媲美呢?生物类似药是否会与原研生物药分庭抗礼,进而取而代之呢?本文就这些疑问进行探讨和阐述。
生物类似药≠原研生物药
首先,我们要搞清“生物药”与“生物类似药”的概念。
生物药即生物制品,是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂[2]。如疫苗、血液制品、单克隆抗体等。生物药的分子量大,存在多级复杂结构。形象地说,若把小分子化学药作为参照,将其比作 “一辆平衡车”的话,那么生物药——单克隆抗体就是“一架飞机”。
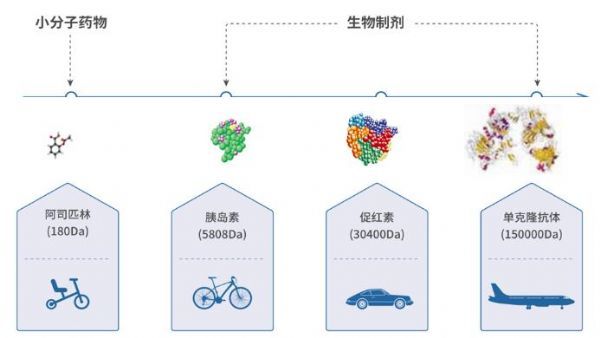
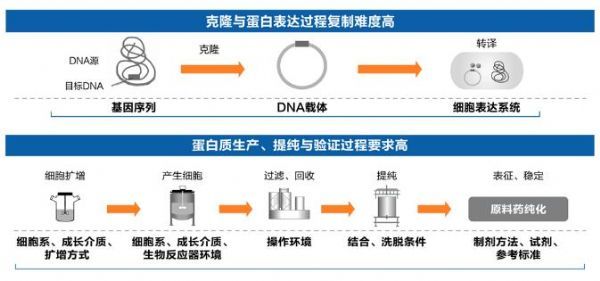
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品;生物类似药候选药物的氨基酸序列原则上应与参照药相同。参照药是指已获批准注册的,在生物类似药研发过程中与之进行比对试验研究用的产品,包括生产用的或由成品中提取的活性成分,通常为原研产品。鉴于生物药结构复杂、工艺繁琐(单抗生产要求更高、过程更复杂,如下图),生物类似药难以完全、精准复制原研生物药。另外,在名称上,生物类似药还被称为“similar biotherapeutic product (类似生物治疗药)”“biocomparables(生物可比药)”“non-originator biological(非原研生物药)”“subsequent entry biologics(随后进入的生物药)”等。从这一层面也足可见,生物类似药仅仅是与原研生物药“类似”“可比”,而绝不可能与原研生物药一样,即生物类似药≠原研生物药。
循证证据:生物类似药<原研药
从研发阶段到临床实际应用的漫长过程中,原研生物药历经大量的临床试验及实践验证。然而,生物类似药的临床数据却十分有限,临床经验也相对匮乏。单从下图3种单抗已完成的临床研究数量对比来看,原研生物药的研究数量与其生物类似药相比,数量高达十倍。另外,就具体案例来讲,如原研生物药曲妥珠单抗的疗效和安全性从全球已完成的784项临床试验中得到了验证,惠及了全球>300万的肿瘤患者,包括>30万的中国患者,循证证据充分,并积累了大量真实世界数据。
单从下图3种单抗已完成的临床研究数量对比来看,原研生物药的研究数量与其生物类似药相比,数量高达十倍。
另外,就具体案例来讲,如原研生物药曲妥珠单抗的疗效和安全性从全球已完成的784项临床试验中得到了验证,惠及了全球>300万的肿瘤患者,包括>30万的中国患者,循证证据充分,并积累了大量真实世界数据。

临床可及性、效价比:生物类似药可能<原研药
《新型抗肿瘤药物临床应用指导原则(2019年版)》强调,在抗肿瘤药物临床应用中,应当充分考虑抗肿瘤药物的效价比,优先选择有药物经济学评价和效价比高的药品。根据药物适应证、药物可及性和肿瘤治疗价值,将抗肿瘤药物分成:普通使用级(有明确的临床使用适应证、已列入《国家基本药物目录》《国家基本医疗保险药品目录》和国家谈判药品的抗肿瘤药物品种)和限制使用级(有明确的临床使用适应证、未列入《国家基本药物目录》或《国家基本医疗保险药品目录》或国家谈判药品的抗肿瘤药物品种)。
2017年,通过“国家谈判”,包括原研生物药曲妥珠单抗在内的36种药品纳入国家医保目录,价格大幅降低(曲妥珠单抗降幅约高达69%),极大地减轻了患者的经济负担,并提升了药物的可及性和可支付性。值得一提的是,2019年,曲妥珠单抗国家医保续约成功,再降24%,进一步降低了患者经济负担,可谓是“贵族药”开出了“平民价”。
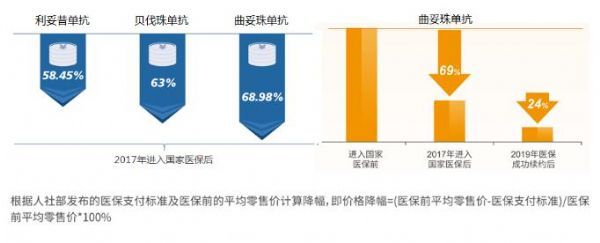
显然,已纳入医保的原研生物药为兼具“可及性”和“效价比”的“普通使用级”抗肿瘤药物,相比生物类似药或更具临床应用优势。
安全性问题或风险:生物类似药>原研药
从免疫原性、适应证外推、可互换性角度,生物类似药可能存在安全性问题或风险,尚需充分的临床验证。因此,选择生物类似药需谨慎。
生物类似药与原研药的免疫原性差异,或致安全性问题
免疫原性是指抗原刺激特定的免疫细胞,使免疫细胞活化、增殖、分化,最终产生免疫效应物质抗体和致敏淋巴细胞的特性。临床上,免疫原性可能影响疗效和安全性:可能会引起过敏反应、输液反应,降低药物有效性。因此,免疫原性的评估已成为确定药物临床安全性、有效性的关键步骤。
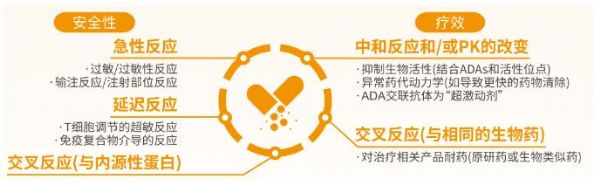
原研药已在全球范围内经过大量临床研究验证,免疫原性得到充分的评估和管理。原研药通常不引起(或仅引起有限的)免疫反应,或者免疫相关不良反应通常并不严重,且很少会威胁生命。因此,在原研药临床应用中无需担心其免疫原性相关问题。
然而,生物类似药无法精确复制原研药,二者难免存在免疫原性差异,并可能导致非预期的免疫原性,降低疗效或产生非预期的不良事件,甚至危及患者生命。同时,生物类似药临床研究治疗随访时间有限,美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)建议免疫原性评估时间为1年。因此,临床应用时需加强安全监控和管理。
适应证外推有一定的安全隐患
适应证外推是指将从一种批准的临床适应证中收集的疗效和安全性数据投射应用至其他情况,且不在这些情况或适应证中另外开展特定临床试验。
国内外权威机构强调,生物类似药进行适应证外推必须具有充分的证据支持,同时也存在一定安全隐患,需要谨慎考虑和合理选择[9-12]。
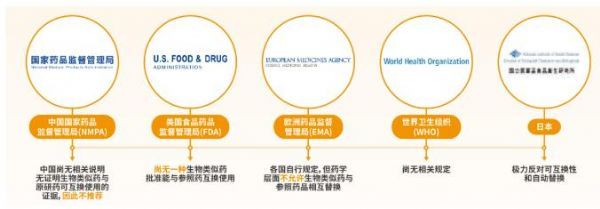
原研药与生物类似药互换风险叵测
生物类似药的可互换性是指将一种药物转换为另一种有相同临床效果药物的可能性。基于缺乏原研药与生物类似药之间、不同生物类似药之间转换用药的临床数据,原研药与生物类似药一旦互换,则可能存在不利于药物疗效、不良反应、药品追溯的风险。
目前,全球多数权威监管机构对于原研药与生物类似药互换持谨慎态度,不建议非临床因素互换。同时,生物类似药使用真实世界研究提示,强制互换易造成失效和停药;互换大规模应用仍需审慎对待;互换还会使药费以外的其他医疗成本增加。
结语
显而易见,在临床证据、安全性、医保等方面,生物类似药尚不能与原研生物药相媲美。在临床应用中,也尚不足以与原研生物药分庭抗礼或取而代之。至于原研生物药和生物类似药的未来治疗前景,仍有待时间考证!
